Мутації гена 29 людського EGFR
Назва продукту
HWTS-TM0012A-Набір для виявлення мутацій гена 29 людського EGFR (флуоресцентна ПЛР)
Епідеміологія
Рак легень став провідною причиною смерті від раку в усьому світі, серйозно загрожуючи здоров'ю людини. Недрібноклітинний рак легень становить близько 80% пацієнтів з раком легень. EGFR наразі є найважливішою молекулярною мішенню для лікування недрібноклітинного раку легень. Фосфорилювання EGFR може сприяти росту, диференціації, інвазії, метастазуванню пухлинних клітин, запобігати апоптозу та сприяти ангіогенезу пухлини. Інгібітори тирозинкінази EGFR (TKI) можуть блокувати сигнальний шлях EGFR, пригнічуючи аутофосфорилювання EGFR, тим самим пригнічуючи проліферацію та диференціацію пухлинних клітин, сприяючи апоптозу пухлинних клітин, зменшуючи ангіогенез пухлини тощо, щоб досягти терапії, спрямованої на пухлину. Велика кількість досліджень показала, що терапевтична ефективність EGFR-TKI тісно пов'язана зі статусом мутації гена EGFR і може специфічно пригнічувати ріст пухлинних клітин з мутацією гена EGFR. Ген EGFR розташований на короткому плечі 7-ї хромосоми (7p12), має повну довжину 200 Кб та складається з 28 екзонів. Мутована область переважно розташована в екзонах з 18 по 21, кодони 746 по 753, делеційна мутація в екзоні 19 становить близько 45%, а мутація L858R в екзоні 21 становить близько 40-45%. У рекомендаціях NCCN щодо діагностики та лікування недрібноклітинного раку легень чітко зазначено, що перед введенням EGFR-TKI необхідне тестування на мутації гена EGFR. Цей тестовий набір використовується для керівництва при введенні препаратів інгібітора тирозинкінази рецептора епідермального фактора росту (EGFR-TKI) та забезпечує основу для персоналізованої медицини для пацієнтів з недрібноклітинним раком легень. Цей набір використовується лише для виявлення поширених мутацій у гені EGFR у пацієнтів з недрібноклітинним раком легень. Результати тесту наведені лише для клінічного ознайомлення та не повинні використовуватися як єдина основа для індивідуалізованого лікування пацієнтів. Клініцисти повинні враховувати стан пацієнта, показання до застосування препарату та лікування. Реакція та інші лабораторні показники та інші фактори використовуються для комплексної оцінки результатів тесту.
Канал
| ФАМ | Реакційний буфер IC, реакційний буфер L858R, реакційний буфер 19del, реакційний буфер T790M, реакційний буфер G719X, реакційний буфер 3Ins20, реакційний буфер L861Q, реакційний буфер S768I |
Технічні параметри
| Зберігання | Рідина: ≤-18℃ У темряві; Ліофілізована: ≤30℃ У темряві |
| Термін придатності | Рідина: 9 місяців; Ліофілізована форма: 12 місяців |
| Тип зразка | свіжа пухлинна тканина, заморожений патологічний зріз, патологічна тканина або зріз, залита в парафін, плазма або сироватка |
| CV | <5,0% |
| Рівень доказів | Виявлення розчину реакції нуклеїнових кислот на тлі 3 нг/мкл дикого типу, може стабільно виявляти 1% частоту мутацій |
| Специфічність | Немає перехресної реактивності з геномною ДНК людини дикого типу та іншими мутантними типами. |
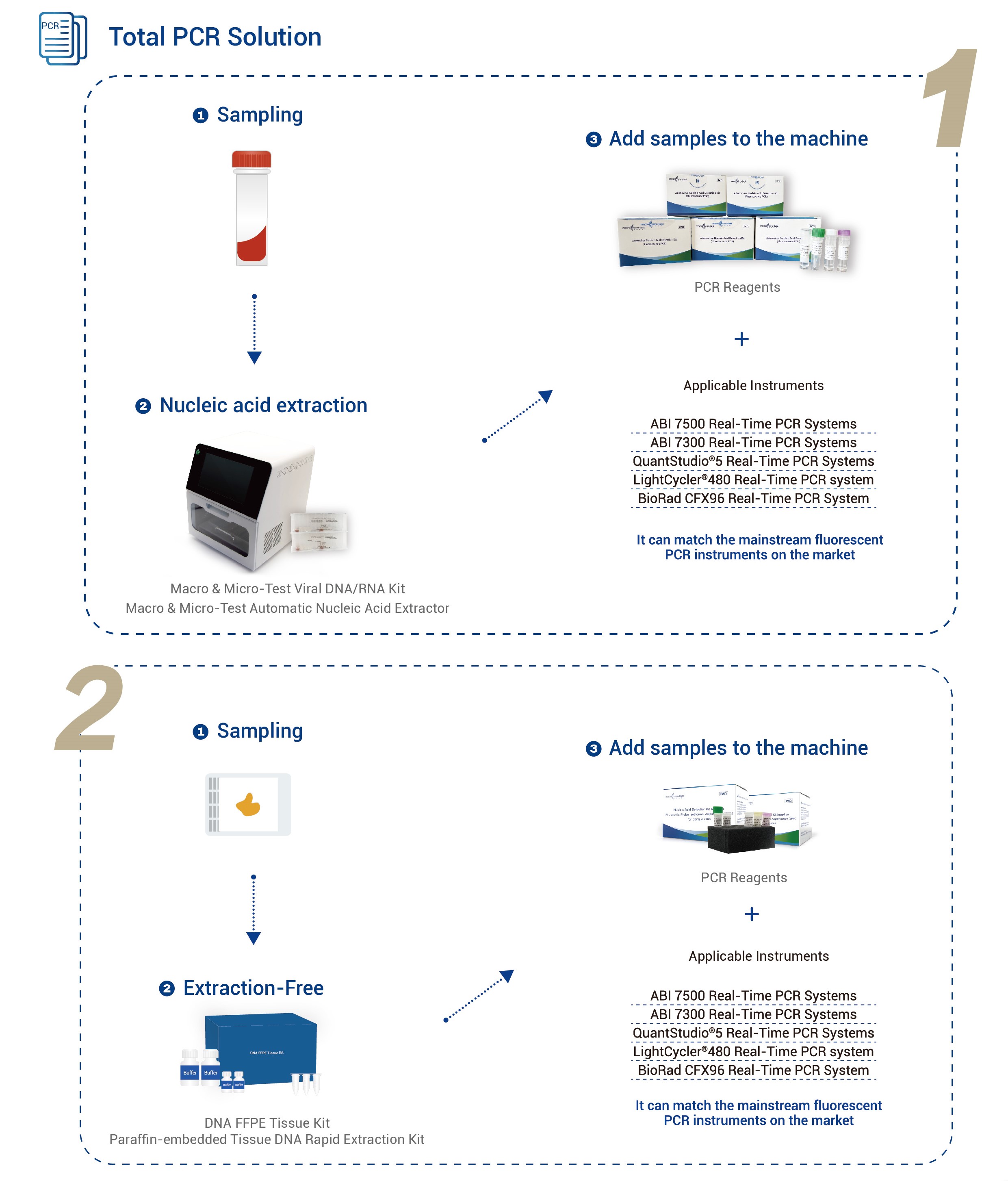
| Застосовувані інструменти | Системи ПЛР у реальному часі Applied Biosystems 7500Системи ПЛР у реальному часі Applied Biosystems 7300 Системи ПЛР у реальному часі QuantStudio® 5 Система ПЛР у реальному часі LightCycler® 480 Система ПЛР у реальному часі BioRad CFX96 |